Antes del Examen
Bancos de Preguntas gratis para UNAM IPM UAM UAEM
Reacción de combustión
Actualizado: 1/14/2021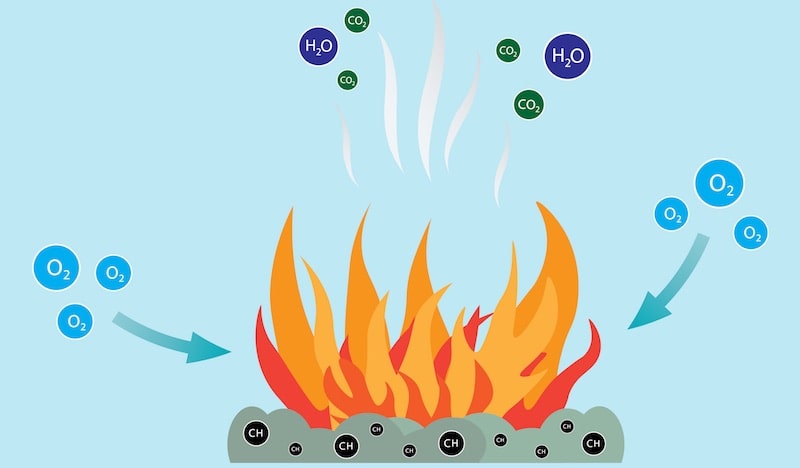
La combustión
Es la reacción química rápida del oxígeno del *aire u oxígeno directo, que se define como comburente, con un combustible. El oxígeno reacciona con la mayoría de los combustibles para generar calor, que se utiliza para realizar trabajo o impulsar procesos químicos. Los principales productos de la combustión son el dióxido de carbono y el vapor de agua; los principales agentes contaminantes de la combustión son los óxidos de nitrógeno, el monóxido de carbono, el dióxido de azufre y las partículas (PM).<
El objetivo principal de la combustión es generar calor, que puede utilizarse para diversos fines, como alimentar motores e impulsar procesos químicos. Los productos de la combustión suelen ser dióxido de carbono y vapor de agua, mientras que los principales contaminantes son los óxidos de nitrógeno, el monóxido de carbono, el dióxido de azufre y las partículas. Para en la mayoría de las aplicaciones, el objetivo es minimizar la contaminación y maximizar la eficiencia.
Hay varias formas de optimizar la combustión, dependiendo de la aplicación concreta. Por ejemplo, en un motor, el objetivo suele ser minimizar las emisiones y maximizar la potencia. En un proceso químico, el objetivo puede ser maximizar el rendimiento y minimizar el aporte de energía.
Es una tipo de reacción química exotérmica. Puede involucrar materia en estado gaseoso o en estado heterogéneo (líquido-gaseoso o sólido-gaseoso). el caso, y agua (H2O).
Combustiones estequiométricas o neutras. Se denomina así a las combustiones completas ideales, que emplean las cantidades justas de oxígeno para su reacción y que ocurren, por lo general, únicamente en el ambiente controlado de un laboratorio.
Combustiones incompletas. Son aquellas reacciones en que aparecen compuestos que no se oxidaron completamente (llamados también inquemados) en los gases de combustión. Tales compuestos pueden ser monóxido de carbono (CO), hidrógeno, partículas de carbono, etcétera.
Reacción de combustión
Los procesos de combustión comprenden en realidad un conjunto de reacciones químicas rápidas y que ocurren de forma simultánea. A cada una de estas reacciones se les puede llamar etapa o fase. Las tres etapas fundamentales de la combustión son:
Pre-reacción o primera etapa. Los hidrocarburos presentes en el material combustible se descomponen y comienzan su reacción con el oxígeno del aire, formando radicales (compuestos inestables molecularmente). Esto inicia una reacción en cadena de aparición y desaparición de compuestos químicos donde, por lo general, se forman más compuestos de los que se descomponen.
Oxidación o segunda etapa. En esta etapa se genera la mayor parte de la energía calórica de la reacción. A medida que el oxígeno reacciona con los radicales de la etapa anterior, se va generando un proceso de desplazamiento violento de electrones. En el caso de las explosiones, un número elevado de radicales conduce a una reacción masiva y violenta.
Fin de la reacción o tercera etapa. Ocurre cuando se completa la oxidación de los radicales y se forman las moléculas estables que serán los productos de la combustión.

Partners
- Somos expertos en productos de hule y caucho para gimnasio,Piso antiderrapante de hule, piso para uso rudo y muchos más usos. En MatMarkt puedes encontrar cualquier tipo de losetas y rollos de caucho industrial.
- En cortina-hawaiana.mx tenemos cortinas hawaianas a la medida, fabricadas conPVC Transparente, para soldadura, antiestática y muchas más
- En rollospvc.com tenemos cortinas hawaianas a la medida, fabricadas conPVC Transparente, para soldadura, antiestática y muchas más
- Ofertas en productos para bebés ennuestro sitio Cazador de Ofertas para Productos de Bebés como Safety 1st, Doona, Uppababy y más!
antesdelexamen es una página de internet gratuita con bancos de preguntas de examen para UNAM, IPN y todas las demás universidades más importantes de México. Tenemos bancos de preguntas por materia y por area. Bancos de preguntas Area 1, Bancos de preguntas Area 2, Bancos de preguntas area 3, Bancos de preguntas Area 4. Simulacros UNAM , IPN, UAM, UAEM. Guía UNAM 2021, Guía IPN 2021.
Agréganos en facebook buscando @antesdelexamen