Antes del Examen
Bancos de Preguntas gratis para UNAM IPM UAM UAEM
Grupos presentes en los aminoácidos
Actualizado: 1/18/2021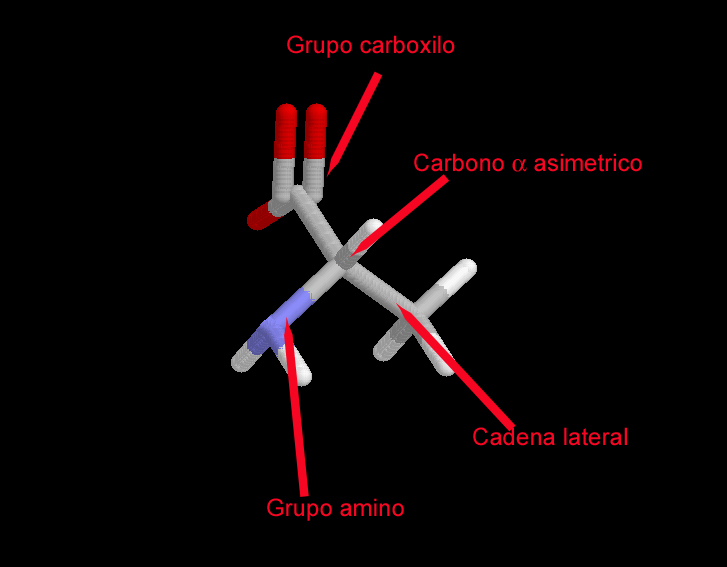
La polaridad de los grupos R varía enormemente desde totalmente apolar o hidrofóbico a altamente polar o hidrofílico. Existen 5 clases principales de a.a.:
Con grupos R apolares y alifáticos
Con grupos R aromáticos (generalmente apolares)
Con grupos polares sin carga
Con grupos cargados negativamente
Con grupos cargados positivamente
Grupos R apolares alifáticos
Los grupos R hidrocarbonados son apolares e hidrofóbicos. Las cadenas laterales voluminosas de alanina, valina, leucina e isoleucina, con sus distintas formas, son importantes para la promoción de interacciones hidrofóbicas dentro de las estructuras proteicas. La glicina (estructura más sencilla) impone el mínimo impedimento estérico, lo que le permite más flexibilidad estructural que cualquier otro a.a. Al contrario, la prolina, por la presencia del grupo amino secundario (imino), reduce la flexibilidad estructural de las proteínas.
Grupos R aromáticos
La fenilalanina, la tirosina y el triptófano con sus cadenas laterales aromáticas son relativamente apolares. Todos ellos pueden participar en interacciones hidrofóbicas, las cuales son especialmente fuertes cuando los grupos aromáticos se apilan (stacking) los unos sobre los otros. El grupo –OH de la tirosina puede formar puentes de H y actúa como un grupo funcional importante en la actividad de algunas enzimas. La tirosina y el triptófano son significativamente más polares que la fenilalanina (grupo –OH y el N del anillo indólico del triptófano). El triptófano y la tirosina, y en menor grado la fenilalanina, absorben la luz ultravioleta. Esto explica la característica absorbancia fuerte de luz por parte de las proteínas a una longitud de onda de 280 nm.
Grupos R polares sin carga
Los grupos R de estos a.a. son más solubles en agua, o hidrofílicos, que los a.a. apolares, debido a que contienen grupos funcionales que forman puente de H con el agua. Aquí se incluyen la serina, treonina, cisteína, metionina, asparagina y glutamina. La polaridad de la serina y treonina proviene de sus grupos hidroxilos; la de la asparagina y glutamina de los grupos amida, y la de la cisteína y metionina de su átomo de azufre. La asparagina y glutamina son las amidas de otro 2 a.a. (aspartato y glutamato), en los que se hidrolizan fácilmente por ácido o base. La cisteína tiene un grupo tiol, que es aprox. Tan ácido como el grupo –OH de la tirosina. La cisteína requiere mención especial, porque se oxida fácilmente formando un aminoácido dimérico unido covalentemente llamado cistina, en la que están unidas 2 moléculas de cisteína mediante un puente disulfuro. Los puentes disulfuros de este tipo se encuentran en muchas proteínas estabilizando sus estructuras.
Grupos R cargados negativamente (acídicos)
Los 2 a.a. que tienen grupos R con carga neta negativa a pH 7 son aspartato y glutamato, cada uno de los cuales tiene un segundo grupo carboxilo.
Partners
- Somos expertos en productos de hule y caucho para gimnasio,Piso antiderrapante de hule, piso para uso rudo y muchos más usos. En MatMarkt puedes encontrar cualquier tipo de losetas y rollos de caucho industrial.
- En cortina-hawaiana.mx tenemos cortinas hawaianas a la medida, fabricadas conPVC Transparente, para soldadura, antiestática y muchas más
- En rollospvc.com tenemos cortinas hawaianas a la medida, fabricadas conPVC Transparente, para soldadura, antiestática y muchas más
- Ofertas en productos para bebés ennuestro sitio Cazador de Ofertas para Productos de Bebés como Safety 1st, Doona, Uppababy y más!
antesdelexamen es una página de internet gratuita con bancos de preguntas de examen para UNAM, IPN y todas las demás universidades más importantes de México. Tenemos bancos de preguntas por materia y por area. Bancos de preguntas Area 1, Bancos de preguntas Area 2, Bancos de preguntas area 3, Bancos de preguntas Area 4. Simulacros UNAM , IPN, UAM, UAEM. Guía UNAM 2021, Guía IPN 2021.
Agréganos en facebook buscando @antesdelexamen